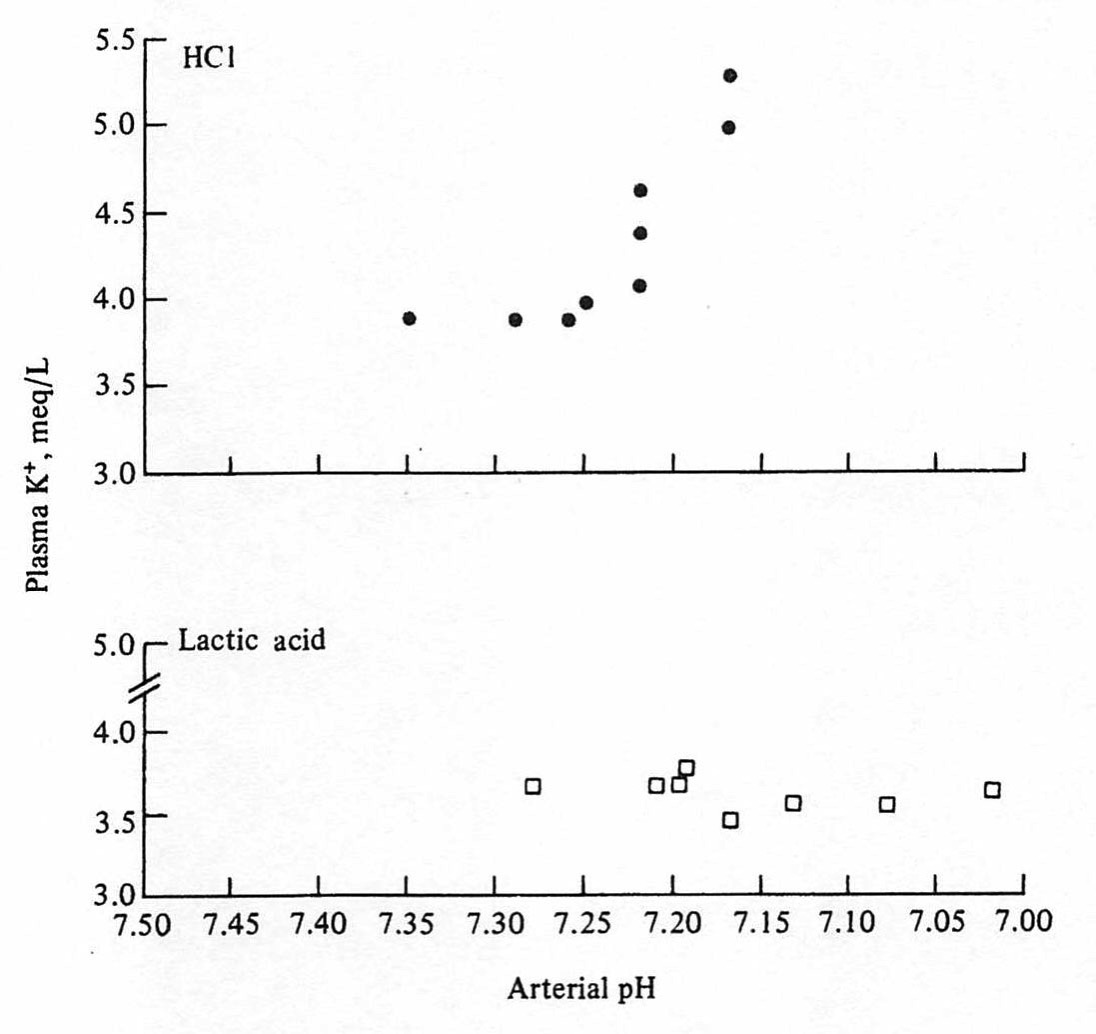
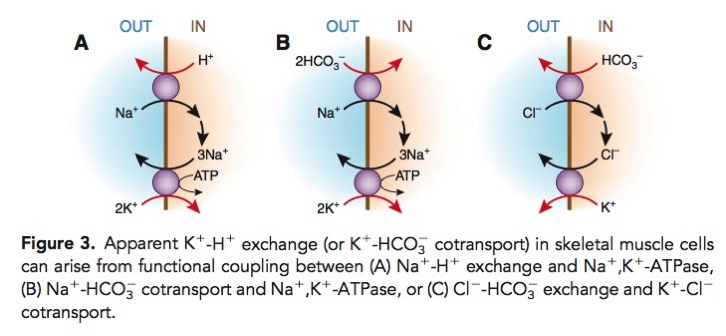
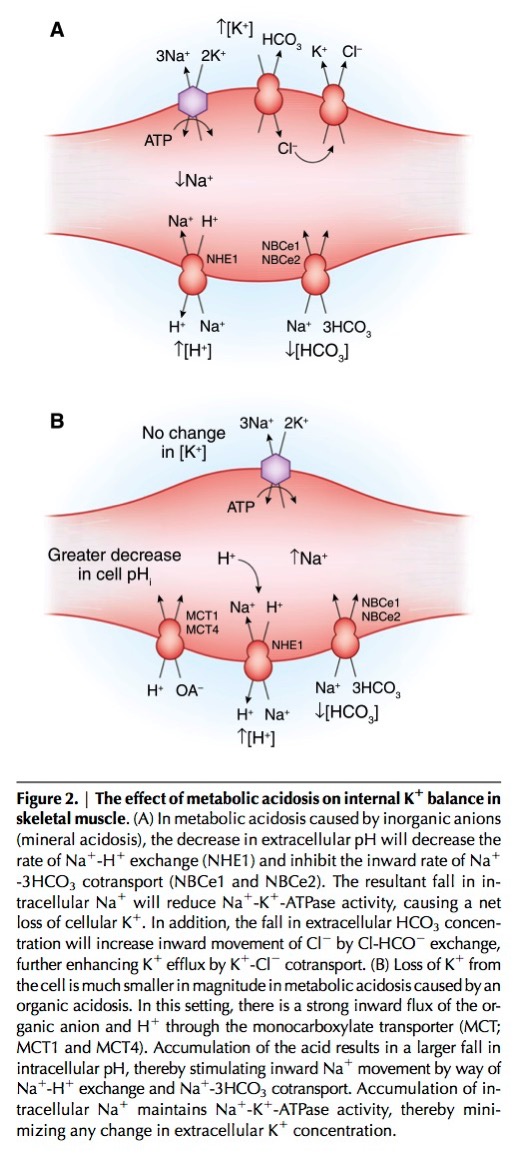
Luo J, Brunelli SM, Jensen DE, Yang A. Association between Serum Potassium and Outcomes in Patients with Reduced Kidney Function. Clin J Am Soc Nephrol. In press 2015.[Pubmed]
CKD患者においては、健常に比べて、血清K異常が多い。重症の高K血症を除けば、血清K異常と予後の関係は不明である。また、eGFRの値によって、血清K異常の頻度や予後との関連を詳細に調べた研究は存在しない。
LuoらはClinical Journal of American Society of Nephrology誌に、eGFRで層別化したCKD患者の血清K異常の頻度と、腎予後の関係について報告した。
米国のマネージドケアHealthCare Partnersの患者のうち、CKD(eGFR<60ml/min/1.73m2)患者で血清K値のデータがある55266名を対象とした。移植患者と透析患者は除外した。
まず、血清K異常の頻度であるが、血清K値5.5-5.9mEq/Lまたは6.0mEq/L以上は低いeGFR群に多く、eGFR 50-59 ml/min/1.73m2では、それぞれ1.7%と0.2%であり、30 ml/min/1.73m2未満では7.6%と1.4%であった。血清K 3.5mEq/L未満はすべてのeGFR群に1.2-1.4%いた。高K血症は糖尿病の合併、冠動脈疾患の合併、RAAS阻害薬の使用と相関があった。また、低K血症は女性に多く、サイアザイド薬の使用と相関があった。
一方、血清K異常と予後(フォローアップの中央値2.76年)の相関であるが、血清K値と死亡率には、U-shapedの相関があり、死亡率は、血清K3.5mEq/L未満で3.05倍、血清K 6.0mEq/L以上で3.31倍高かった。各eGFR群においては、重大な心血管イベント、入院、RAAS阻害薬の中止と、血清K濃度にはU字の相関が認められた。
以上の結果より、透析をおこなっていないCKD患者においては、高K血症、低K血症とも独立に、死亡、MACE、入院、RAAS阻害薬の中止と相関があると結論づけた。今後、血清K値を正常に保つことで、予後がどのようになるのか調べる必要があるだろう。