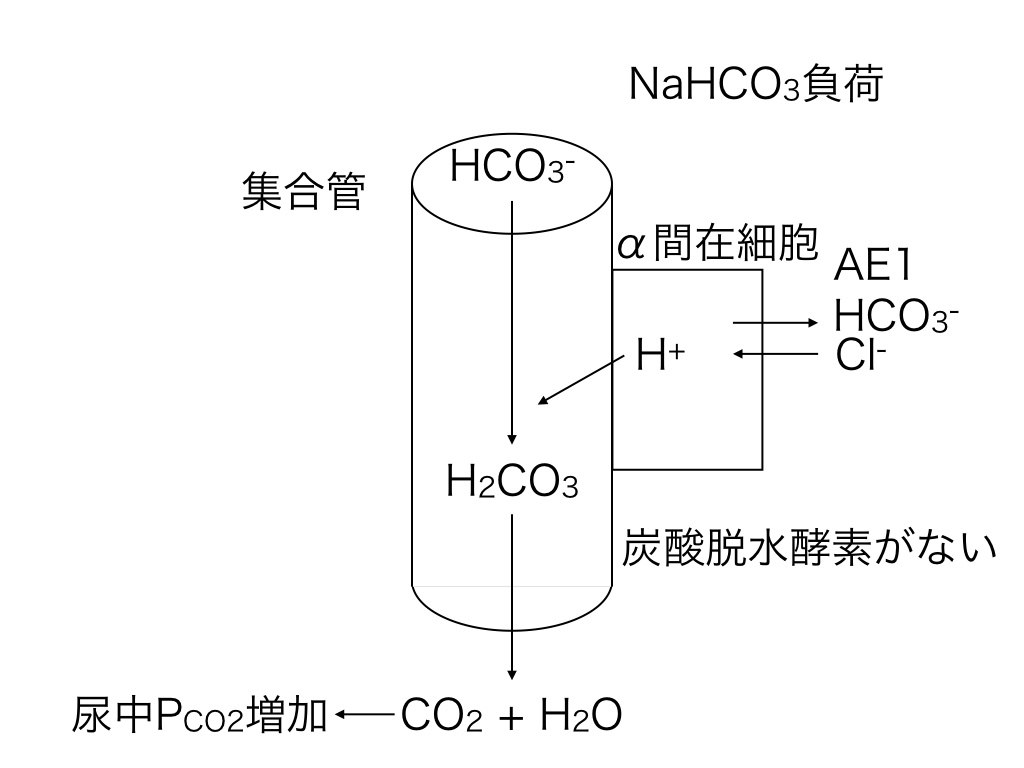
健常人においては、尿中NH4+排泄は20-40 mmol/日であるが、慢性アシドーシスにおいて,、腎臓はNH4+排泄を200 mmol/日以上まで増やすことができる。尿中NH4+排泄を増やすことができないことが、尿細管性アシドーシスの病態として重要である。したがって、尿中NH4+排泄量はAG正の代謝性アシドーシスにおいて、下痢かRTAかを鑑別するためのキーになる。
尿NH4+濃度をルーチンに測定できる施設は少ないので、通常、推定を行うが、推定する方法は、2つあり、尿アニオンギャップ(AG)と尿浸透圧ギャップを利用する方法がある。
(1)尿AGを利用する方法
尿AGは以下の式で定義される。
尿AG = UNa + UK – UCl
尿中の主な陽イオンはNa+、K+、NH4+であり、主な陰イオンはCl-である。したがって、UNH4+はUNa + UKとUClの差から推定できるという考え方である。健常人においては、尿AGは通常プラスの値(20-90 mmol/L)である。下痢などのアシドーシスによって、適切にNH4+排泄が増加すると、UClが増えるので、尿AGがマイナス値になる。遠位型RTAなどでは、適切にNH4+排泄を増加できないため、尿AGがプラス値のままである。したがって、尿中NH4+排泄を直接に測らなくても、尿AGによって、アシドーシスに対する尿中NH4+排泄が適切かどうかのおおよその判断ができることになる。
まとめると、
AG正の代謝性アシドーシスにおいて、UAG正(通常20~90mEq/L)だと、NH4排泄が正常ないし少なく、代謝性アシドーシスの原因はRTAである。
AG正の代謝性アシドーシスにおいて、UAG負(通常-20~-50mEq/L)だと、NH4排泄が増加しており(通常80mEq/L以上)、代謝性アシドーシスの原因は下痢である。
尿AGを利用する方法には制限があり、アンモニアとともに排泄される陰イオンがCl-の時に限られる。つまり、トルエン中毒のように、尿中に大量の馬尿酸陰イオンが排泄されるような場合には使えない。
ここで、「ハルペリン病態で考える電解質異常」45ページにある式2について考えてみたい。ハルペリンでは、尿AGという用語は使わずに尿中総電荷数という用語を使っている。式2は
–UNH4 = (UNa + UK)ー(UCl + 80)
であるが、これは、尿中のみ測定の陰イオンと陽イオンの差が80mEqと一定であることを示している。上に書いたように、尿AG = UNa + UK – UCl = 20〜90で UNH4は20〜40であるので、
UNa + UK + UNH4 – UCl = 0〜50
UNa + UK + UNH4 = UCl + 0〜50
ということになる。つまり、80のかわりに0〜50という値を使っているということになる。ハルペリンらも、未測定の陰イオンの排泄量は食事摂取によって大きく変わるので、80というのはあてにならないとしている。
(2)尿浸透圧ギャップを利用する方法
もう一つの尿中NH4+排泄量を推測する方法は、尿浸透圧ギャップを利用する方法である。通常、尿の浸透圧を形成するのは、Na塩、K塩、ブドウ糖、尿素、NH4塩であることを利用する。
尿浸透圧ギャップは、
測定したUosm – {2 x (UNa + UK) + Uglucose (mg/dL) / 18 + Uurea (mg/dL)/ 2.8}
尿浸透圧ギャップの正常範囲は10-100 mOsmol/kgであり、尿中NH4+排泄量はこの値の半分(5-50 mmol/L)である(NH4+と同量の陰イオンがあるため)。下痢などによるアシドーシスでNH4+排泄が増加するときには、尿浸透圧ギャップは>200 mOsmol/kgとなる。
NH4+の1日あたりの排泄量を計算する場合には、Ucreatinineを同時に測定し、健常人での尿クレアチニン排泄量が20mg/kg体重/日(0.2 mmol/kg体重/日)であることから推算する。腎臓が正しく働いている場合には、慢性アシドーシスに対し、NH4+排泄量は200-300mEq/日まで増加し、75mEq/日未満の場合はNH4+排泄に障害があると考える。
まとめると、慢性アシドーシス患者で尿浸透圧ギャップが150 mosmol/kg未満なら、腎臓はNH4排泄を増加できていないので、遠位型RTAまたは高K血症型RTAと考える。一方、400 mosmol/kg以上なら、腎臓のNH4排泄は正常に増加しており、下痢などを考える。
尿浸透圧ギャップを利用する方法が尿AGを利用する方法より優れている点は、NH4+がCl-以外の陰イオンととともに排泄されるときにも使えるという点である。逆に、尿浸透圧ギャップを利用する方法が問題となるのは、尿路感染症の時や、アルコールやマンニトールなどの浸透圧物質が存在する時である。
重要なことは、これら2つの方法はあくまでも定性的なNH4+排泄の目安であり、定量的な方法ではないと言うことを認識することである。実際に、Haらによれば、尿AGを用いた方法、尿浸透圧ギャップを用いた方法と尿中NH4+の実測値の間には、十分な相関はみられなかったとしている。どちらかと言えば、尿浸透圧ギャップの方が相関は高い。
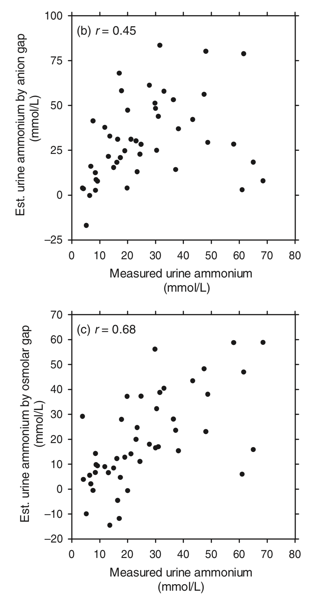
Ha LY, Chiu WW, Davidson JS. Direct urine ammonium measurement: time to discard urine anion and osmolar gaps. Ann Clin Biochem. 2012;49(Pt 6):606-8.
ハルペリンをはじめとして、尿浸透圧ギャップを用いた方法を勧めているが、尿中の尿素、グルコース、尿浸透圧をルーチンに測っているケースは少ないと思われるので、尿AGを用いるのでも十分なのだと思う。
参考文献
- Rastegar M, Nagami GT. Non-Anion Gap Metabolic Acidosis: A Clinical Approach to Evaluation. Am J Kidney Dis. 2017;69(2):296-301.
- Soleimani M, Rastegar A. Pathophysiology of Renal Tubular Acidosis: Core Curriculum 2016. Am J Kidney Dis. 2016;68(3):488-98.
- Michael Emmett, MDBiff F Palmer, MD: Urine anion and osmolal gaps in metabolic acidosis. In: UpToDate, Post TW (Ed), UpToDate, Waltham, MA. (Accessed on December 31, 2018.)