尿細管アシドーシスや下痢などによる無機酸の蓄積によるアシドーシスでは、H+が細胞に入るのと入れ替えに、K+が細胞から外に出てくるため、血清Kが上昇する。一方で、乳酸アシドーシスやケトアシドーシスのような有機酸の蓄積によるアシドーシスでは血清Kは上昇しない。この現象は、以下の論文でもきれいにしめされている。
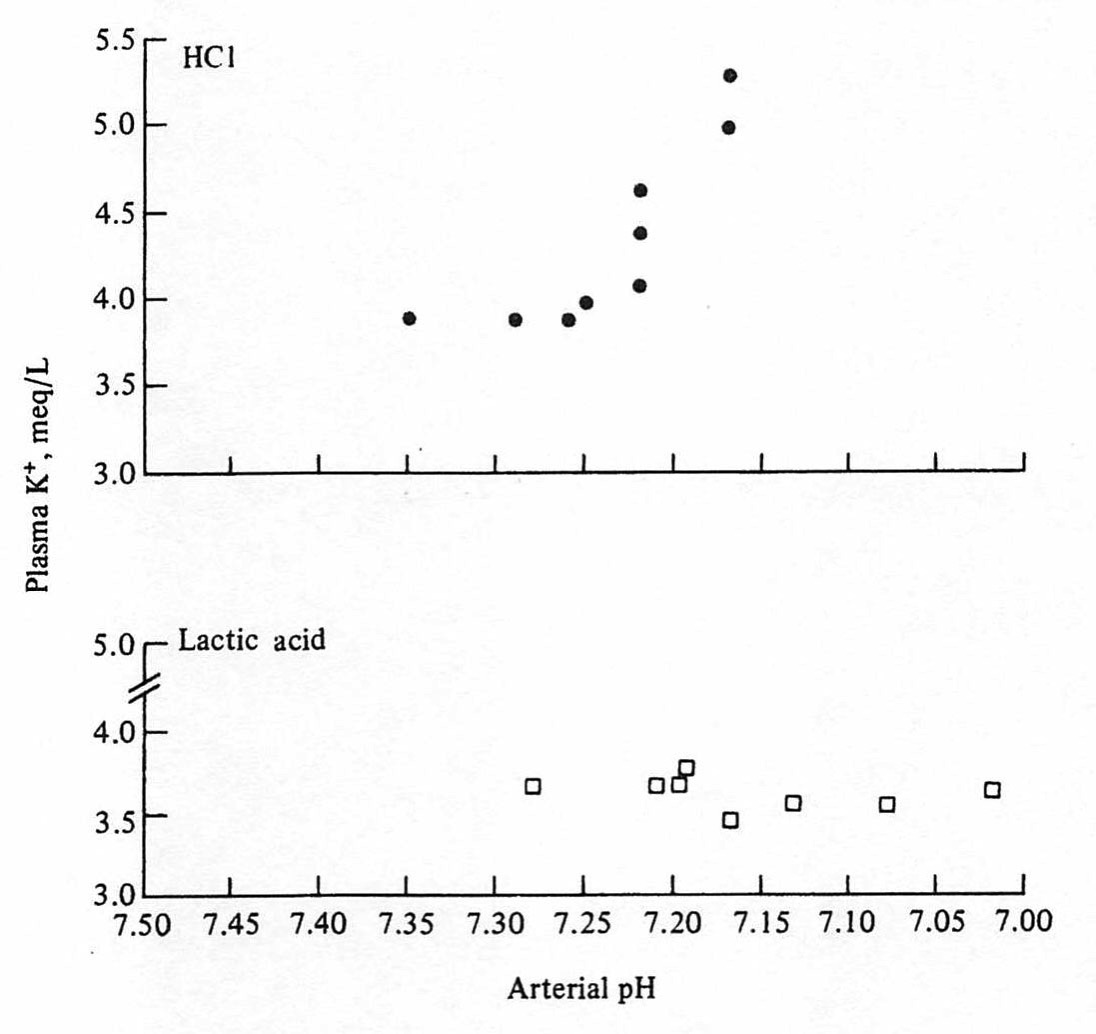
(ROSEの本よりコピー)
Perez GO, Oster JR, Vaamonde CA. Serum potassium concentration in acidemic states. Nephron. 1981;27(4-5):233-43.
そのメカニズムについては、以下のように考えられている。
そもそも、Kのもっとも大きな貯蔵庫となっている筋肉においてはK-H交換体という実体は存在しない。実際には、複数のトランスポーターがカップリングすることで、最終的に、HとKが交換されるようになっている。
具体的には、
- Na+-H+交換体とNa+-K+-ATPaseのカップリング
- 2HCO3—Na+交換体とNa+-K+-ATPaseのカップリング
- HCO3—Cl-交換体とK+-Cl-交換体とのカップリング
などがある。
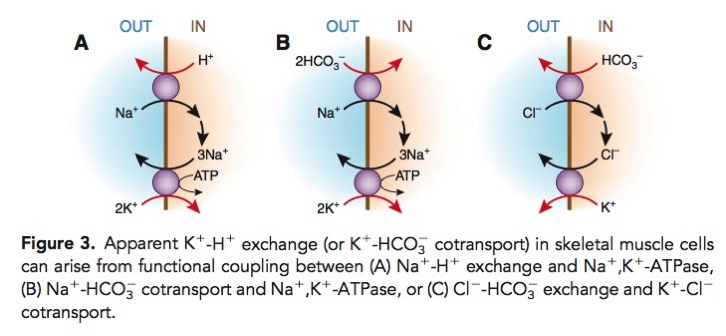
Aronson PS, Giebisch G. Effects of pH on potassium: new explanations for old observations. J Am Soc Nephrol. 2011;22(11):1981-9.
無機酸によるアシドーシスの場合、H+が増えると、Na-H交換体が活性化し、細胞内のNa濃度が下がる。したがって、Na-K-ATPase活性も低下するので、血清K濃度が上昇する。
一方、有機酸によるアシドーシスの場合、血清Kは上昇しないが、そのポイントは、筋肉にはmonocarboxylate transporter (MCT; MCT1 and MCT4)が存在すると言うことにある。有機酸によるアシドーシスの場合、monocarboxylate transporterにより有機酸塩とH+は細胞内に取り込まれ、細胞内のH+濃度が上昇することにより、Na+-H+輸送体が活性化し、細胞内Na+濃度が上昇する。それにより、Na-K-ATPaseが活性化し、細胞外のKは細胞内に取り込まれるために、血清Kは上昇しないのである。
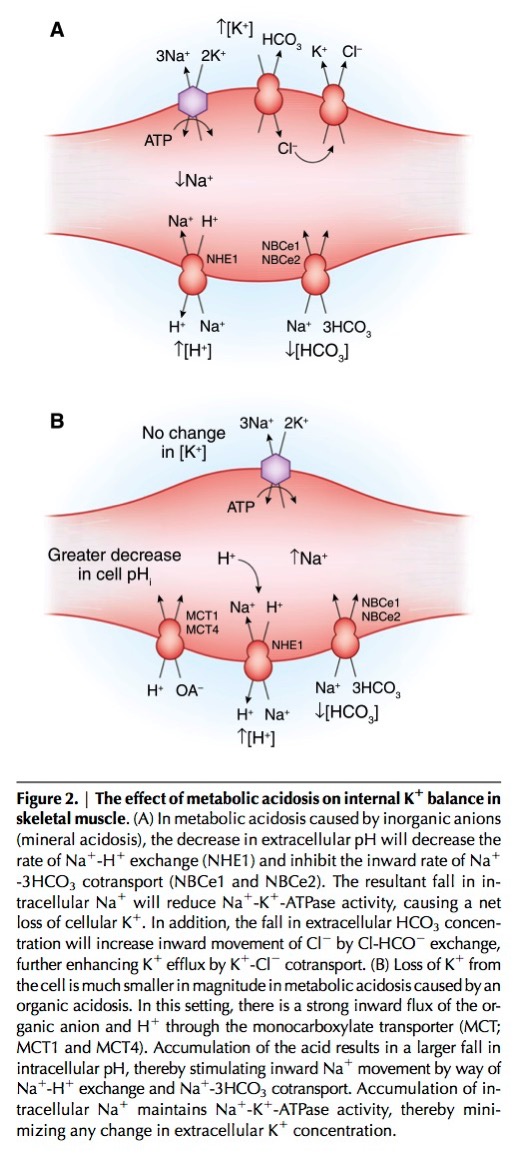
Palmer BF. Regulation of Potassium Homeostasis. Clin J Am Soc Nephrol. 2015;10(6):1050-60.






